在小鼠胚胎发育期间,在胚胎日(E) 10.5左右,在主动脉-性腺-中肾(AGM)区域首次检测到决定性造血。造血干细胞(hsc)产生于主动脉背侧的主动脉内造血细胞簇(IAHCs)。我们之前报道过一种转录因子Sox17在IAHCs中表达,其中CD45lowc-Kithigh细胞具有较高的造血活性。此外,在这种细胞群中强制表达Sox17可以维持造血细胞簇的形成。然而,Sox17是如何做到这一点的,特别是涉及的下游信号,仍然知之甚少。本研究的目的是寻找新的Sox17靶点,这些靶点有助于形成具有造血活性的簇。
通过rna测序(RNA-seq)分析,鉴定与sox17阴性IAHCs相比,表达sox17的IAHCs中表达上调的基因。在前7位高表达基因中,本研究重点研究了已报道的血管特异性调控基因Rasip1,首先进行了全挂载免疫染色。我们通过荧光素酶报告基因实验和染色质免疫沉淀(ChIP)实验来检测Sox17是否通过结合其增强子元件来调节Rasip1基因的表达。我们还分析了rasip1转导细胞和rasip1敲低sox17转导细胞的簇形成和多系集落形成能力。
与未表达sox17的对照组相比,sox17阳性CD45lowc-Kithigh细胞中Rasip1表达水平升高。此外,sox17核易位增加了Rasip1基因的表达水平。Rasip1在IAHCs的膜上表达,与内皮细胞标志物CD31和造血干细胞/祖细胞标志物c-Kit重叠。在IAHCs中,大部分c-Kit+Sox17+细胞均有Rasip1表达。荧光素酶报告基因实验和ChIP实验表明,在Rasip1增强子区域的五个推测的Sox17结合位点中,有一个对通过Sox17结合表达Rasip1很重要。在sox17转导的细胞中,Rasip1的敲低降低了簇的形成,降低了集落的形成能力,而在CD45lowc-Kithigh细胞中,Rasip1的过表达导致造血活性显著但短暂的增加。
在sox17转导的CD45lowc-Kithigh细胞中,Rasip1敲低显示出多系集落形成能力和簇大小的显著降低。在sox17未转导的CD45lowc-Kithigh细胞中,Rasip1过表达导致多系集落形成能力显著但短暂的增加,这表明存在一种持续造血活性的协同因子。
在小鼠个体发育过程中,胚胎造血是从包裹胚胎的卵黄囊的血岛开始的[1],这被称为原始造血[2]。在胚胎日(E) 10.5左右,在主动脉-性腺-中肾(AGM)区域首次检测到最终的造血[3]。含有hsc的主动脉内造血细胞簇(IAHCs)附着在背主动脉内壁上[3],起源于内皮的一个特殊亚群,即所谓的造血内皮[4],其具有分化产生内皮细胞和造血细胞的能力[5]。IAHCs中的细胞表达多种标记蛋白。其中,血管内皮-钙粘蛋白(vascular endothelial-cadherin, VE-cad)、CD31等内皮细胞标志物在IAHCs血管壁侧的细胞上表达。造血细胞标志物CD45在IAHCs血管腔侧的细胞上表达,而造血干细胞/祖细胞(HSPC)标志物c-Kit在簇细胞上表达[5,6,7,8]。造血干细胞由血管内皮细胞跨越动脉内簇产生,内皮细胞中Runx1功能对于造血祖细胞和造血干细胞的形成至关重要[9]。缺乏Runx-1转录因子的小鼠在小鼠胚胎妊娠中期的背主动脉中没有这种细胞簇,而Runx-1转录因子是最终造血所必需的[5,8]。IAHCs中这些标记蛋白的表达模式表明造血谱系的特异性发生在细胞簇内[10]。
CD45的表达通常被认为是除成熟红细胞和血小板外所有造血细胞的标志物。在某些情况下,CD45与造血干细胞/祖细胞(HSPC)标记物c-Kit一起用于分离妊娠中期AGM区域的造血干细胞/祖细胞(HSPC)。在以往的研究中,cd45阴性和低水平表达的群体具有长期的再繁殖活性[6],而cd45表达的群体具有分化能力[11,12]。我们之前的研究[13,14]表明,分离AGM区域的原代培养细胞[15],似乎是AGM区域的体外造血繁殖,根据CD45和c-Kit的表达谱[13,14],至少可以将细胞分为CD45lowc-Kit+, CD45lowc-Kit?和CD45highc-Kitlow/?群体。CD45lowc-Kithigh细胞在体外具有最高的造血能力和体内的长期重建能力[16]。然后,在E11.5之后,AGM区的造血迅速减少,在E13.5时消失,在E12.5时造血的主要部位转移到胎儿肝脏[16,17]。
一种内胚层转录因子sry相关高流动性组(HMG)盒17 (Sox17)以及其他f组(SoxF)蛋白Sox7和Sox18在E10.5 IAHCs中表达[10]。Sox17是内胚层细胞的标记物,是一种含有dna结合结构域的转录调节因子,称为HMG盒子[18,19]。缺乏sox17的胚胎在内胚层来源的肠管形成方面存在缺陷,并且在妊娠中期是致命的[20]。Sox17在主动脉背侧造血细胞簇血管壁侧的细胞中表达,在内皮细胞中特异性表达[10,21]。此外,小鼠胚胎干(ES)细胞分析显示,胚胎体(EBs)中强制表达sox17的细胞分化为造血内皮细胞和造血细胞[10]。缺乏Sox17的条件敲除小鼠表明,Sox17对胎儿造血很重要,但对成人造血不起作用[16]。来自E11.5 AGM区的Sox17+VE+细胞在小鼠中表现出多系造血重建[21]。这些表达模式暗示Sox17调控早期HSPCs的发育。我们之前报道过,E10.5 AGM区域的CD45lowc-Kithigh细胞群虽然规模较小,但在所有按CD45和c-Kit表达水平分类的群体中,其造血活性最高[16]。在E10.5 AGM CD45lowc-Kithigh细胞中强制表达Sox17导致在体外与基质细胞共培养至少8代期间形成一致的细胞团。相反,在Sox17转导的细胞中,Sox17的敲低导致与基质细胞共培养的含有粒细胞和巨噬细胞的造血集落分散[10]。这些报道表明,Sox17有助于维持AGM区造血细胞群中具有干细胞表型的细胞,下调Sox17可诱导造血分化[10]。
Notch信号通路在胎儿造血过程中起重要作用。notch1基因敲除小鼠胚胎被发现具有决定性造血功能缺陷和血管形成异常[22]。研究表明,Sox17直接与Notch1的启动子区相互作用,诱导Notch1的表达,进而诱导Hes1表达[17,23]。Sox17-Notch1-Hes1轴被认为在维持sox17 -转导细胞的未分化状态中发挥作用[17,23]。此外,血小板生成素(TPO)信号通路对于形成sox17转导的高表达TPO受体c-Mpl的iahc和维持造血活性非常重要。在E10.5胚胎的IAHCs中观察到c-Mpl的表达,刺激TPO导致AGM区内皮细胞出现造血细胞[24]。
到目前为止,我们已经证明在AGM区域的IAHC细胞中引入Sox17会导致具有造血潜能的细胞簇的形成[10,17,23,24,25],并假设Sox17通过与其启动子的相互作用诱导靶基因的表达维持未分化状态。这些基因包括Notch1[17]、ESAM和VE-Cad [23], Sox17诱导的每个基因在维持未分化状态方面可能具有不同的功能。然而,这些基因如何发挥作用,赋予Sox17簇形成和造血活性,以及是否仍有未识别的Sox17靶基因,仍有待确定。在本研究中,根据Kayamori等人[26]的方法,利用在带有Sox17起始密码子的框架中携带增强GFP基因的小鼠[27,28],通过RNA-seq分析鉴定了来自10.5 AGM区域的表达Sox17的IAHCs中与不表达Sox17的IAHCs相比上调的基因。在本研究中,我们将重点放在Rasip1基因上,因为在前7个高表达基因中,据报道Rasip1是一种血管特异性调节基因,但不被认为是一种造血调节基因。我们在这里进一步展示了Rasip1在E10.5 AGM区含hsc的IAHC细胞的维持中的功能作用。
ICR小鼠购自日本SLC。动物实验按照东京医科牙科大学动物保健委员会批准的机构指南进行(批准文号:A2018-265C, A2019-108C, A2021-177C, A2023-146A)。
从E10.5 ICR小鼠中切除的AGM区域在1 mg/ml disase II (Roche, basel, Switzerland)中37°C孵育20分钟。用停止液[含10% (v/v)胎牛血清(FCS)和250μg/ml DNase I (Roche)的Hank 's平衡盐溶液(HBSS)]洗涤细胞后,将细胞重悬于含2% (v/v) FCS的Dulbecco 's modified Eagle 's medium (DMEM)中。细胞采用植红蛋白(PE)偶联抗小鼠CD45 (30-F11)和异藻蓝蛋白(APC)偶联抗小鼠c-Kit (2B8)抗体(eBioscience, San Diego, CA, USA)进行免疫染色。将染色细胞悬浮在添加2% (v/v) FCS和1μg/ml碘化丙啶(PI) (Calbiochem, Darmstadt, Germany)的DMEM中,通过FACS Aria II (Becton Dickinson, Lincoln, NJ, USA)进行分析。流式细胞术结果用FlowJo (Three Star Inc., Ashland, VT, USA)进行分析。经筛选的CD45lowc-Kithigh细胞在α- minimal essential medium (α-MEM)中接种于OP9基质细胞,培养基中添加10% (v/v) FCS、25 ng/ml干细胞因子(SCF, PeproTech, Rocky Hill, NJ)、10 ng/ml白细胞介素-3 (IL-3, PeproTech)和10 ng/ml血小板生成素(TPO, PeproTech)。
按照前面的描述进行RNA-seq分析[26]。我们使用杂合子胚胎的AGM区域,其中Sox17基因被增强的GFP基因取代[27,28]。使用RNeasy Mini Kit (Qiagen)从E10.5 Sox17 (GFP)+小鼠AGM区衍生的CD45lowc-Kithigh细胞中分离总RNA, DMSO、30 nM PTC299、200 nM地西他滨以及两种药物的组合处理。逆转录后,使用Next Ultra DNA文库准备试剂盒(New England BioLabs)从片段DNA生成RNA-seq文库。TapeStation (Agilent)对文库进行定量后,使用HiSeq1500 (Illumina)对样品进行测序。RNA-seq原始读取(fastq文件)被映射到小鼠基因组。从BAM文件中提取小鼠基因组的片段的基因水平计数。然后使用袖扣(版本2.2.1)计算基因表达值,以每千碱基外显子单位每百万映射reads的读数计算。表S1描述了来自同一组E10.5 Sox17-GFP胚胎的Sox17 (GFP)+ CD45lowc-Kithigh细胞和Sox17 (GFP) - CD45lowc-Kithigh细胞中检测的基因表达水平。在本表中,用FPKM + 1的值计算Sox17 (GFP)+ CD45lowc-Kithigh细胞与Sox17 (GFP)?CD45lowc-Kithigh细胞之间的基因表达量之比。这些基因是根据前者与后者的比例列出的。表1为表S1中筛选出的前7个基因。
用于包装异位逆转录病毒的平板- e细胞[29]在转染前1天播种。将插入目标基因的pMY载体用Trans IT-293 Reagent (Mirus, Madison, WI, USA)转染到PlatE包装细胞中。培养2天后,收集含有逆转录病毒的培养基。用编码Sox17-、Sox17- ert -、rasip1 -内部核糖体进入序列(IRES)- gfp或Sox17-IRES- mcherry基因的逆转录病毒感染E10.5 AGM区CD45lowc-Kithigh细胞,在10μg/ml聚乙烯存在下,在37℃下培养2.5 h。转导后的细胞与OP9基质细胞在含有10% FCS、25 ng/ml SCF、10 ng/ml IL-3和10 ng/ml TPO的α-MEM中共培养。
用E10.5 AGM区的CD45lowc-Kithigh细胞感染sox17 - ert - ires - gfp编码逆转录病毒[30]。转导后的细胞与添加SCF、IL-3和TPO的OP9基质细胞共培养,添加或不添加他莫昔芬(1μg/ml柠檬酸他莫昔芬)。培养3天后,流式细胞术对sox17 - ert - ires - gfp转导的细胞进行分选。从分选细胞中分离总RNA合成cDNA, RT-PCR分析Rasip1的表达。
根据先前描述的方案进行全挂载免疫染色[5,17,23]。E10.5 ICR小鼠胚胎在2%多聚甲醛(PFA)中冰敷20 min。PBS洗涤后,用含有2% (w/v)牛血清白蛋白的PBS- mt [1% (w/v)脱脂奶粉和0.4% (v/v) Triton X-100]冰处理1小时,然后用大鼠抗小鼠CD117 (c-Kit)抗体(2B8;BD Pharmingen),山羊抗小鼠CD31抗体(Bio-Techne, Minneapolis, MN, USA)和兔抗小鼠Rasip1抗体(Proteintech, Rosemont, IL, USA)在4°C下过夜。免疫染色的胚胎用PBS-MT洗涤3次,每次1小时,然后用Alexa Fluor 647偶联的驴抗大鼠IgG (Jackson ImmunoResearch, West Grove, PA, USA)、Alexa Fluor 546偶联的驴抗山羊IgG (Invitrogen, Oregon, USA)和Alexa Fluor 488偶联的驴抗兔IgG (Invitrogen)染色。在一些实验中,胚胎用大鼠抗小鼠CD117 (C - kit)抗体(eBioscience)、兔抗小鼠Rasip1抗体(Proteintech)和山羊抗人Sox17抗体(R&D Systems, Minneapolis, MN, USA)在4°C下进行过夜免疫染色。R&D Systems的数据表显示,山羊抗人Sox17抗体可以在B16小鼠黑色素瘤细胞系中清晰地检测到小鼠Sox17蛋白。该抗体也有报道能有效识别小鼠胚胎中的Sox17蛋白[10,23]。洗三次后,这些胚胎用Alexa Fluor 647偶联的驴抗大鼠IgG (Jackson ImmunoResearch)、cy3偶联的驴抗兔IgG (Jackson ImmunoResearch)和Alexa Fluor 488偶联的驴抗山羊IgG (Invitrogen)在PBS-MT中4°C染色过夜。PBS- mt洗涤3次,每次1 h后,用Hoechst 33258 (Nacalai Tesque, Kyoto, Japan)在PBS- t (PBS中0.4% [v/v] Triton X-100)中染色20 min, 4°C, PBS- t洗涤2次,每次20 min, 4°C。用50% (v/v)的甲醇/PBS在4℃下处理10 min,然后用100%甲醇在4℃下处理2次,每次10 min。胚胎在50% (v/v)甲醇/苯甲醇和苯甲酸苄酯的混合物(1:2,BABB)中洗涤三次。最后,将胚胎装入BABB。共聚焦激光扫描显微镜(LSM 510;卡尔蔡司,德国Oberkochen)。
NIH3T3细胞(1.0 × 106)用pEFBOSE载体编码Sox17, Sox17G103R突变体,破坏dna结合能力,pGL3载体(Promega, Madison, WI, USA)携带推测的Rasip1增强子或点突变的Rasip1增强子,pRL-CMV或pRL-TK用Trans-IT LT1试剂(Mirus, Madison, WI, USA)编码海三色系荧光素酶基因。3天后,将细胞溶解,用双荧光素酶报告分析系统(Promega)监测细胞裂解物中的荧光素酶活性,并使用Mithras LB 940 (Berthold Technologies, Bad Wildbad, Germany)进行定量。首先,使用pRL-CMV载体(Promega)和Sox17G103R突变体进行对照荧光素酶实验。荧光素酶检测主要采用pRL-TK载体(Promega)。
ChIP- it Express Enzymatic Kit (Active Motif, Carlsbad, CA, USA)进行ChIP assay。将Sox17-IRES-GFP基因逆转录到E10.5小鼠胚胎的CD45lowc-Kithigh细胞中。将转导后的细胞与OP9细胞共培养,孵育4天后,将这些细胞重新植入新的OP9基质细胞。几代传代后,收获sox17转导的细胞(1.2 × 108个细胞),用1%甲醛溶液(37%甲醛,Sigma Aldrich, St. Louis, USA)在20 ml αMEM中固定10分钟。PBS洗涤2次后,细胞用溶解缓冲液加蛋白酶抑制剂混合物和PMSF (ChIP-IT Express Enzymatic Kit, Active Motif)处理。接下来,用Dounce匀浆器对细胞进行匀浆,并用酶解缓冲液(Digestion Buffer)添加蛋白酶抑制剂鸡尾酒和PMSF (ChIP-IT Express Enzymatic Kit, Active Motif)处理细胞核。然后,使用酶切鸡尾酒(ChIP-IT Express enzymatic Kit, Active Motif)在37°C下酶切染色质5min,添加冷EDTA停止。酶解染色质样品经RNAase和蛋白酶K处理(ChIP-IT Express Enzymatic Kit, Active Motif),苯酚/氯仿提取,然后按照方案进行DNA沉淀。通过1%琼脂糖凝胶电泳分离样品的aliquote,以检查最佳消化DNA的存在。然后,将剩余样品与放射免疫测定级BSA (Wako, Osaka, Japan)包被的Protein G磁珠(ChIP-IT Express Enzymatic Kit, Active Motif)和正常山羊IgG对照(R&D Systems)或山羊抗人Sox17抗体(R&D Systems)混合过夜。用ChIP缓冲液(ChIP- it Express Enzymatic Kit, Active Motif)洗涤磁珠后,用洗脱缓冲液洗脱免疫沉淀的染色质,进行反交联和蛋白酶K处理(ChIP- it Express Enzymatic Kit, Active Motif)。用以下引物扩增纯化的DNA片段:sox17结合义5 ' -CATATGACAAGTCTGGTAGCC-3 '和反义5 ' -ACATCGCCAATACTTGTATCTG-3 '。
用9-mer核苷酸间隔物TTCAAGAGA设计的shRNA序列和发夹寡核苷酸[31]在pMKO中U6启动子下游退火。shRNA序列为:5 ' -GCTTGAAACTGCATCGCTT-3 ' (shRasip1)和5 ' -ACTTACGCTGAGTACTTCG-3 ' (shLuc)。在同样含有U6启动子shrasip1或shLuc的逆转录病毒载体中,GFP基因在SV40启动子的控制下表达[9]。将shRNA和GFP构建物通过逆转录病毒导入由E10.5 CD45lowc-Kithigh细胞衍生的sox17 - ires - mcherry转导的细胞中,然后与OP9细胞共培养4天。共培养4天后,sox17 - ires - mcherry转导的细胞形成表达明亮GFP (shRNA)的簇。这些簇的图像是用荧光显微镜拍摄的。每个Mock和shrna转导的细胞簇的体积由Wu等人描述的公式评估[32]。簇体积=length × width2/2,其中length表示最大直径,width表示与最大直径垂直的直径。然后我们对GFP+细胞进行分选,并在半固体培养基(Methocult M3434, Stem Cell Technologies, Vancouver, Canada)中培养7天后评估集落形成能力(2.5 × 103个GFP+细胞)和Rasip1表达水平(2.0 × 104个GFP+细胞)。通过ImageJ评估Rasip1 KD效率,并以百分比表达与β-actin表达比较。
将分选的细胞溶解在ISOGEN (WAKO,大阪,日本)中,并根据制造商的方案回收rna。然后,从分选细胞中分离总RNA合成cDNA。将Rasip1基因敲低或过表达的表达值归一化为β-肌动蛋白基因的表达值。使用rTaq (TAKARA Bio Inc., Otsu, Japan)在以下条件下进行PCR扩增:96°C 3 min,然后96°C 30 s, 55°C 30 s, 72°C 30 s循环。使用的处理剂套装如下:
-
5 ' -GTGACAGATGACGCATTGCATAGAGAA-3 '
-
3“-ACTCAAACTCTCAGCCGTCTACGCAGG-5”(Rasip1)
-
5“-CCAGGGTGTGATGGTGGGAA-3”;3“-CAGCCTGGCTGGCTACGTACA-5”(β肌动蛋白)
将编码Rasip1的全长cDNA插入到带有flag标记的pMY-IRES-GFP载体中。用编码Rasip1-IRES-GFP基因的逆转录病毒在10 mg/ml聚布胺的存在下感染E10.5 AGM区制备的CD45lowc-Kithigh细胞2.5 h。在OP9基质细胞上培养4天后,用FACS Aria II对编码gfp的病毒感染细胞进行分类,并重新接种到新的OP9基质细胞上,使rasip1转导的细胞增殖。这个过程每3或4天重复一次。
所有荧光素酶活性和菌落计数数据均以平均值±标准差表示。使用学生t检验对两个样本进行比较。
摘要
背景
方法
结果
讨论
结论
数据和材料的可用性
缩写
参考文献
致谢
作者信息
道德声明
补充信息
搜索
导航
#####
我们之前报道过E10.5 AGM区域的CD45lowc-Kithigh细胞群在所有按CD45和c-Kit表达水平分类的人群中具有最高的造血活性[23]。此外,我们已经证明转录因子Sox17的强制表达导致体外形成具有造血活性的细胞团[10],而转录因子Sox17先前被认为在E10.5 AGM CD45lowc-Kithigh细胞中维持胎儿造血的造血活性。在本研究中,我们首先使用RNA-seq分析比较了E10.5 Sox17启动子-GFP敲入胚胎AGM区Sox17 (GFP)+ CD45lowc-Kithigh细胞和Sox17 (GFP) - CD45lowc-Kithigh细胞的基因表达水平。表1列出了可能成为Sox17转录靶点的前7个高表达基因。在Sox17 (GFP)+ CD45lowc-Kithigh细胞中高表达的前7个基因中,Rasip1是在小鼠胚胎造血中研究最少的基因。因此,由于Rasip1被报道为一种血管特异性调节因子,我们将重点放在了Rasip1基因参与E10.5 AGM区域簇细胞形成的过程中。Rasip1是一种血管特异性的GTPase信号传导、细胞结构、粘附和小管形成的调节蛋白[33,34,35,36]。如图1A(下面板)所示,Rasip1在内皮细胞和CD45lowc-Kithigh细胞中表达。
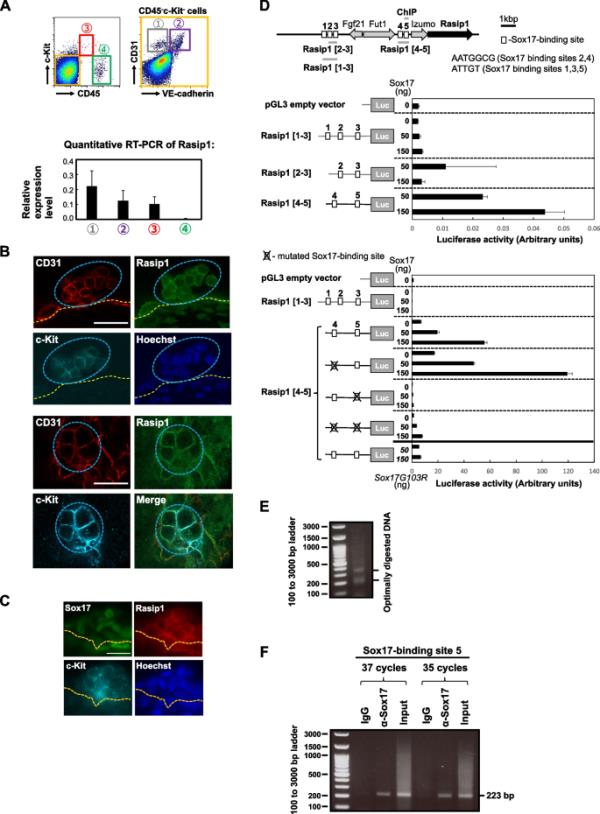
Rasip1在E10.5 AGM区域IAHCs中的表达。A上图:CD45、c-Kit、CD31和VE-Cad在E10.5 AGM区域的表达谱。数字1 ~ 4表示按表达谱分离的细胞群:(1)CD45 - c-Kit - CD31+ VE-cad -细胞(内皮细胞);(2) CD45?c-Kit?CD31+ VE-cad+细胞(内皮细胞);(3) CD45lowc-Kithigh细胞(含HSPCs);(4) CD45+c-Kit?细胞(造血细胞)。下图:RT-PCR显示了这4个人群中Rasip1的相对表达水平。B E10.5 AGM区域IAHCs中Rasip1(绿色)、CD31(红色)和c-Kit(青色)的全载免疫荧光染色。IAHCs膜上Rasip1的表达。细胞核用Hoechst 33,258染色(蓝色)。比例尺,20μm。C E10.5 AGM区域IAHCs中Sox17(绿色)、Rasip1(红色)和C - kit(青色)的全载免疫荧光染色。细胞核用Hoechst 33,258染色(蓝色)。Rasip1在IAHCs中大部分c-Kit+ Sox17+细胞中表达。比例尺,20μm。图中显示了Rasip1基因和上游基因在小鼠7.5号染色体上可能的sox17结合位点的位置,用1到5的方框表示。上图:Sox17诱导Rasip1基因所需的近端推测Sox17结合位点(5)。用含有推测的Rasip1增强子序列的pGL3载体转染NIH3T3细胞(1 × 106)。pRL-CMV共转染作为内部对照。区域Rasip1 [1-3] (979 bp)有三个推测的Sox17结合位点(1、2和3),区域Rasip1 [2-3] (602 bp)有两个推测的Sox17结合位点(2和3)。区域Rasip1 [4-5] (720 bp)有推测的Sox17结合位点4和5。增强子区域显示了两种类型的sox17结合位点:(1)AATGGCG (sox17结合位点2、4)和(2)ATTGT (sox17结合位点1、3、5)。下图:sox17诱导的Rasip1基因激活被sox17结合位点5的突变抑制。用pGL3载体转染NIH3T3细胞(1 × 106), pGL3载体含有推测的Rasip1增强子序列,在推测的Sox17结合位点4或5上发生点突变,或者与编码野生型(WT) Sox17或Sox17G103R的质粒一起转染,这些质粒失去了DNA结合能力。本实验以pRL-TK共转染为内对照。黑色实线表示Rasip1[4-5]区域,灰色实线表示作为对照的pGL3载体和Rasip1增强子区域[1-3]。E.酶消化染色质衍生的DNA。酶解染色质DNA电泳分析。右边的两个条形图显示了F. ChIP实验中最佳消化DNA的存在。用抗sox17抗体或正常山羊IgG对消化后的染色质样品进行免疫沉淀。从免疫沉淀物中提取DNA样本,用PCR扩增含有sox17结合位点5 (Rasip1)的区域[5];见图1D顶图)。预计PCR片段长度为223 bp。对不同天数购买的E10.5胚胎分别获得的2个独立制备的细胞进行2组独立PCR扩增,得到了相似的结果
我们之前通过原位全载杂交证实了Sox17在E10.5 AGM区IAHCs的基底细胞中表达,并且用Sox17转导的CD45lowc-Kithigh细胞保持未分化状态[4]。免疫组织化学检测野生型(WT)胚胎IAHCs中Rasip1的表达。如图1B所示,在c-Kit+ IAHC细胞的细胞膜上检测到Rasip1的免疫反应性,同时检测到内皮细胞标志物CD31的免疫反应性。我们在AGM区域的主动脉内皮和IAHC细胞膜部位观察到Rasip1的表达。如图1C所示,Rasip1、c-Kit和Sox17抗体全挂免疫染色表明,Rasip1在大部分c-Kit+和Sox17+ IAHC细胞中表达。
为了评估Sox17对Rasip1激活的影响,我们首先在Rasip1基因的上游区域寻找推测的Sox17结合位点。在该区域观察到5个推测的sox17结合位点(图1D)。我们检测了增强子结构的荧光素酶活性,其中Rasip1[1,2,3]包含前三个推测的Sox17结合位点,Rasip1[2,3]包含第二和第三个推测的Sox17结合位点,Rasip1[4,5]包含另外两个推测的Sox17结合位点,不同数量的载体编码Sox17或其无dna结合能力的突变体(图1D)。如图1D(上面板)所示,Sox17的引入导致Rasip1[4,5]结构的Rasip1增强子活性以剂量依赖的方式增加。相比之下,Sox17G103R突变体中,Gly103被Arg取代以破坏其dna结合活性,并没有诱导推定的Rasip1增强子区域Rasip1的荧光素酶活性[4,5](图1D,下图,底部对条)。此外,当Sox17蛋白缺失或发生无功能突变,或Rasip1基因中假定的Sox17结合位点5发生突变时,Rasip1[4,5]结构的Rasip1增强子活性突然下降(图1D,下面板)。这些数据表明Sox17结合到Rasip1增强子区并诱导Rasip1基因的表达。
接下来,我们通过ChIP检测Sox17是否与Rasip1基因增强子区域的Sox17结合位点5结合。为此,我们将Sox17-IRES-GFP基因逆转录导入E10.5小鼠胚胎的CD45lowc-Kithigh细胞中,与本研究的其他一些关键实验一样,通过几代扩增具有造血活性的簇状细胞。用Dounce匀浆机对细胞进行匀浆,细胞核制备过程按照“方法”中的描述对染色质进行酶切。图1E(右侧两个条)显示了根据制造商程序(ChIP-IT Express Enzymatic Kit, Active Motif)以及根据核小体之间的连接体DNA(约45 bp)的报道长度(147 bp)所显示的最佳消化DNA的存在[37]。然后,用抗sox17抗体或正常IgG免疫沉淀消化的染色质样品。从免疫沉淀物中提取DNA片段,用PCR方法分析Sox17与Rasip1基因增强子区Sox17结合位点5的结合。如图1F所示,在抗Sox17抗体沉淀的DNA样品中明显存在预期大小的PCR产物,而在对照IgG沉淀的DNA样品中未检测到预期大小的PCR产物,说明Sox17与Sox17结合位点5相互作用。
我们之前的研究表明,当从E10.5 AGM区分选的CD45lowc-Kithigh细胞用Sox17-IRES-GFP病毒转导,并与带有SCF、IL3和TPO的OP9基质细胞共培养时;sox17转导的细胞形成具有高造血活性的细胞团[4]。因此,我们通过RT-PCR分析检测了Rasip1在sox17转导的CD45lowc-Kithigh细胞中的表达水平。如图2A所示,Rasip1基因在sox17转导的细胞中明显表达,而在模拟转导的细胞中几乎可以忽略。这一结果表明Rasip1基因是Sox17的靶标,并暗示Rasip1可能参与了Sox17转导的细胞簇的形成。
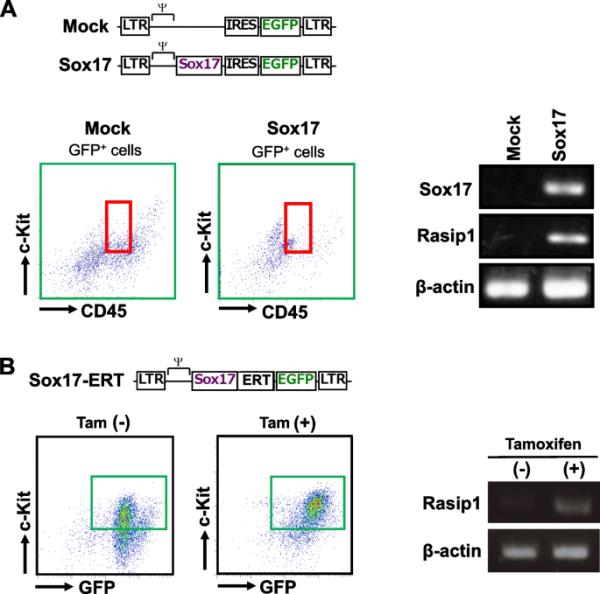
Rasip1在Sox17 (GFP)转导CD45low c-Kithigh细胞中的表达。上图:Sox17-IRES-GFP (Sox17)和IRES-GFP (Mock)逆转录病毒载体图。下图:红色方块显示CD45lowc-Kithigh细胞群区域。用RT-PCR分析模拟或sox17转导细胞中Rasip1的表达,并用β-actin归一化。B上图:Sox17-ERT-IRES-GFP逆转录病毒载体示意图。下图:深绿色方格显示Sox17 (GFP)+ CD45lowc-Kit。高细胞。FACS分选后,在sox17 - ert - ires - gfp转导的细胞中,加或不加他莫昔芬(1.0μg/ml)进行Rasip1基因的表达分析。
接下来,我们通过RT-PCR分析了从E10.5 AGM中分离出来的sox17 - ert转导的CD45lowc-Kithigh细胞中Rasip1的表达水平。他莫昔芬是一种剂量依赖性转运Sox17-ERT融合蛋白进入细胞核的试剂。如图2B所示,CD45lowc-Kithigh细胞中依赖他莫昔芬的Sox17-ERT蛋白的核输入导致Rasip1的表达水平较对照组增加。总之,这些结果与荧光素酶实验和ChIP实验的结果一致,这意味着Sox17转录因子与诱导Rasip1表达密切相关。
为了证实Rasip1对形成具有高造血活性的细胞簇的贡献,我们用sox17转导的细胞感染了编码针对荧光素酶(shLuc)和Rasip1 (shRasip1)的shRNA的逆转录病毒和一个GFP基因。基质细胞培养4天后,我们发现大多数细胞表达mCherry,即Sox17(图3A,左下面板)。这是因为,没有Sox17, AGM细胞失去了维持细胞簇形成的能力[10]。在mCherry+ (Sox17+)细胞中,我们在一定程度上观察到GFP+细胞(shLuc-或shrasip -转导细胞)(图3A,右下面板)。通过FACS对所需数量的GFP+细胞进行分类,如图3B所示,分别用于分析shLuc-和shrasip1转导细胞中的Rasip1表达和/或集落形成实验。通过ImageJ评估,在shRasip1转导的细胞中,Rasip1的表达水平降低了42%(图3B,右图)。此外,我们注意到,通过引入shRNA下调Rasip1表达的sox17转导细胞显示其总集落形成活性和多系集落形成活性降低(图3C)。这些结果表明,敲低Rasip1的细胞体外造血能力下降。
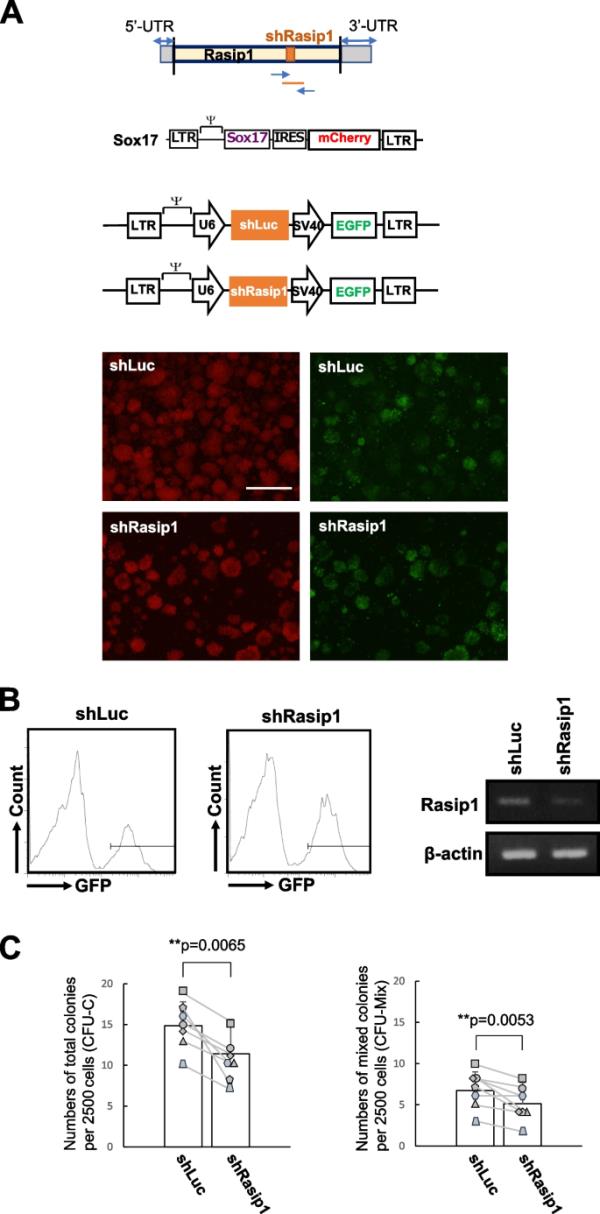
CD45lowc-Kithigh细胞中的Rasip1敲低(KD)。上图:Rasip1 shRNA在Rasip1 mRNA、Sox17-IRES-mCherry逆转录病毒载体、shLuc和shRasip1逆转录病毒载体中的位置图。下图:Sox17-IRES-mCherry转导4天后,sox17转导的细胞形成细胞团。将shLuc和shRasip1导入到sox17转导的细胞中,与OP9基质细胞共培养。shRasip1(绿色,GFP+)转导的Sox17+细胞(红色,mCherry+)的形态。比例尺,1.0 mm。流式细胞术恢复了B shLuc-或shrasip1转导的GFP+细胞。通过RT-PCR分析shLuc-和shrasip1转导细胞中Rasip1的表达,并通过β-肌动蛋白基因表达归一化。由于电泳中的样品顺序,RT-PCR结果在静态图像中,该静态图像是由原始图像在水平轴上的镜像反转产生的。C分选的GFP+细胞(2.5 × 10.3)包埋在半固体培养基中。培养7天后对总菌落(CFU-C)和混合菌落(CFU-Mix)计数。绘制各实验组的菌落编号对(sh-Luc和shRasip1),并用直线连接。每个符号表示在E10.5只小鼠的每窝细胞制备中观察到的菌落数(n=7,7只小鼠,每实验组设7只小鼠)。*p≤0.05;**p≤0.01
我们注意到,与对照相比,表达Rasip1-GFP的细胞倾向于形成更小的簇(图4A,左两个面板)。因此,我们计算并比较了这些簇的平均体积(图4A,右面板)。有趣的是,shrasip1转导的簇的平均体积明显低于shluc转导的簇。这一观察结果支持了Rasip1参与细胞簇形成的观点。接下来,我们对GFP表达水平相对较高的shLuc-GFP和shRasip1-GFP细胞进行分类,即sh构建体表达水平相对较高的细胞(图4B,左上两个面板)。对分选后的细胞进行RT-PCR分析Rasip1转录本。如图4B(右上面板)所示,通过ImageJ筛选的shRasip1-GFP高表达细胞中,Rasip1的表达降低了36%。相比之下,如补充图2A(右图)所示,通过ImageJ评估,经过分类的shRasip1-GFP低表达细胞在转录水平上的Rasip1表达仅下降8.8%。高表达Rasip1敲低构建的细胞(图4B下图)的总集落形成活性和多系集落形成活性显著降低,而极低表达Rasip1构建的细胞(补充图2B)的集落形成活性没有降低。这一结果表明,Rasip1表达的降低导致造血活性的降低。
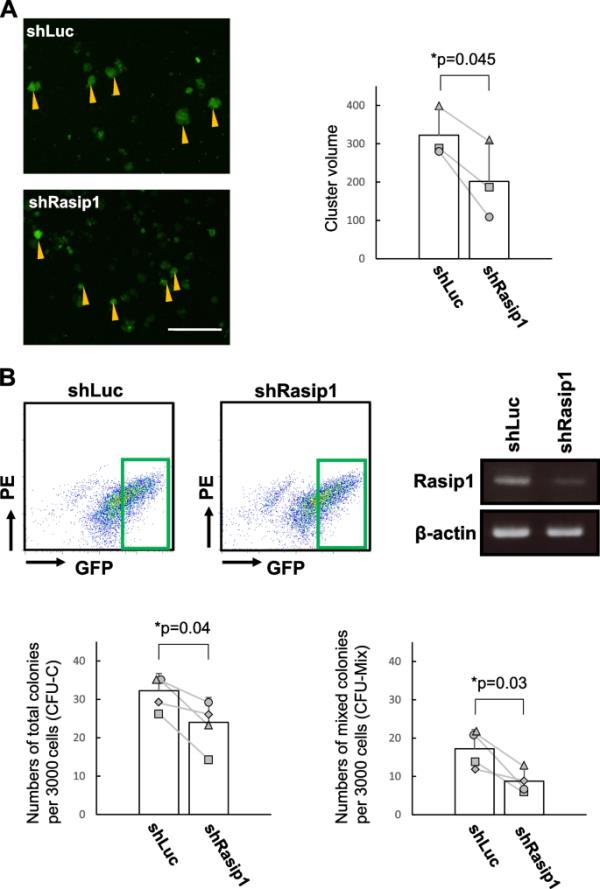
sox17转导的CD45lowc-Kithigh细胞中的Rasip1敲低(KD)A GFP+细胞簇的形态学。黄色箭头为亮绿色表达的细胞群(高强度GFP+)。柱状图显示平均体积和标准差(n=3,3窝小鼠,每实验组设3窝)。比例尺,200μm。测定各组(shLuc和shRasip1)中GFP高表达细胞团的平均体积,分析方法如下:(1)测定最长直径和垂直直径,以最长直径为准;(2)计算平均体积为:簇体积=length × width2/2,其中length表示簇直径最大,width表示簇直径最长的垂直直径;(3)计算了单个实验中10个簇的平均体积;(4)计算3个实验的总平均体积(n=3,每实验组设3窝小鼠)。B上图:FACS恢复了GFP+表达水平较高的shLuc-或shrasip1转导的细胞,即sh构建体表达水平较高的细胞。如FACS图所示,深绿色方块表示高GFP+细胞群。通过RT-PCR分析shLuc-和shrasip1转导细胞中Rasip1的表达,并通过β-肌动蛋白基因表达归一化。由于电泳中的样品顺序,RT-PCR结果在静态图像中,该静态图像是由原始图像在水平轴上的镜像反转产生的。下面板:分选的GFP+细胞(3.0 × 10.3)包埋在半固体培养基中。培养7天后对总菌落(CFU-C)和多系菌落(CFU-Mix)数量进行计数。绘制各实验组的菌落编号对(sh-Luc和shRasip1),并用直线连接。每个符号表示在E10.5只小鼠的每窝细胞制备中观察到的菌落数(n=4,每实验组设4窝小鼠)。*p≤0.05
为了评估Rasip1在IAHCs造血活性中的作用(图5A),我们在体外测试了Rasip1过表达细胞的造血活性。我们用编码IRES-GFP基因(Mock)或Rasip1-IRES-GFP基因(Rasip1)的逆转录病毒转导CD45lowc-Kithigh细胞,并将其与OP9基质细胞共培养(图5B,第0天)。共培养4天后,我们在面板2中观察到(1)CD45lowc-Kithigh和(2)CD45lowc-Kitlow群体,前者在模拟转导的细胞中缺失(图5C,左两个面板)。图5C中红色方块所示的细胞(左两个面板)被包埋在半固体培养基中进行集落形成试验。如图5D顶部两张图(集落测定1)所示,与模拟转导的细胞相比,rasip1转导的细胞形成总集落(CFU-C)和混合集落(CFU-Mix)的能力明显更高。接下来,我们检查了在rasip1转导的细胞与OP9细胞传代培养过程中是否保持这种能力。在传代培养中,在初始培养8天后,图5C(右两个面板)中红色方块所示的细胞被分选并进行集落形成试验。如图5D下两张图(菌落测定2)所示,rasip1转导细胞的总菌落数(CFU-C)明显大于模拟对照组,而rasip1转导细胞的混合菌落数(CFU-Mix)与模拟对照组相比无统计学意义。用Rasip1转导的细胞至少维持了7天的多能集落形成活性。因此,这些结果表明,Sox17的下游靶基因Rasip1赋予Sox17未转导的CD45lowc-Kithigh AGM细胞维持造血活性的能力,尽管这种能力是短暂的。
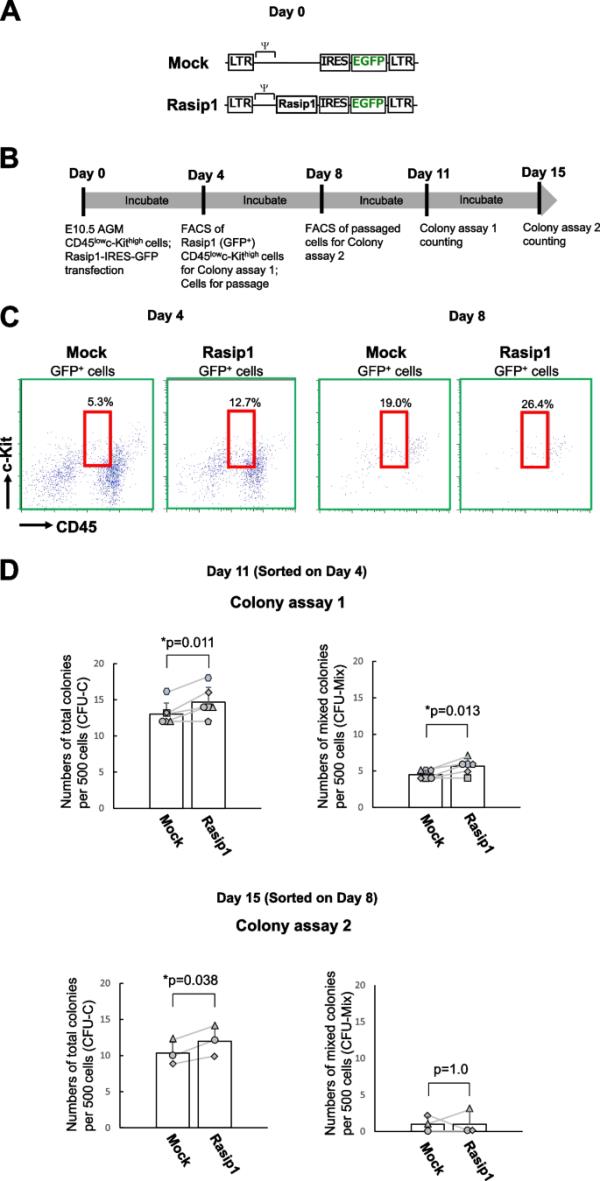
Rasip1在CD45lowc-Kithigh细胞中的过表达(OE)。A IRES-GFP (Mock)和Rasip1-IRES-GFP逆转录病毒载体图。B Rasip1 OE实验时间线。C红色方块表示Mock和rasip1转导的CD45lowc-Kithigh细胞。D在模拟和Rasip1转导4天后,将CD45lowc-Kithigh细胞(2.5 × 102)包埋在半固体培养基中(集落试验1)。根据B中的时间轴,在Rasip1转导8天后(集落试验2)对CD45lowc-Kithigh细胞进行分选(5.0 × 10.2)。培养7天后(n=5)对总(CFU-C)和多系(CFU-Mix)菌落数量进行评分。绘制各实验组的菌落编号(Mock和Rasip1)对,并用直线连接。每个符号表示在E10.5只小鼠的每窝细胞制备中观察到的菌落数(n=6,每实验组设6窝小鼠)。*p≤0.05
下载原文档:https://link.springer.com/content/pdf/10.1186/s41232-023-00292-4.pdf

 微信扫一扫打赏
微信扫一扫打赏

